
Dalam fisika atom, model Bohr, dirancang oleh Niels Bohr, menggambarkan atom sebagai sebuah inti kecil bermuatan positif dikelilingi oleh elektron yang berjalan di orbit lingkaran sekitar-inti serupa dalam struktur tata surya, tetapi dengan gaya elektrostatik memberikan daya tarik, daripada gravitasi. Ini merupakan perbaikan pada model sebelumnya kubik (1902), model puding prem-(1900), model Saturnus (1904), dan model Rutherford (1911). Karena model Bohr merupakan modifikasi kuantum fisika berbasis dari model Rutherford, banyak sumber mengkombinasikan kedua, mengacu pada model Rutherford-Bohr.
Diperkenalkan oleh Niels Bohr pada tahun 1913, kunci sukses model terbaring dalam menjelaskan formula Rydberg untuk garis emisi spektral atom hidrogen. Sementara formula Rydberg sudah dikenal secara eksperimental, tidak mendapatkan fondasi teoritis sampai model Bohr diperkenalkan. Tidak hanya model Bohr menjelaskan alasan untuk struktur formula Rydberg, ia juga memberikan pembenaran untuk hasil empiris dalam hal konstanta fisika dasar.
Model atom Bohr adalah sebuah model primitif dari atom hidrogen. Sebagai sebuah teori, hal itu dapat diturunkan sebagai sebuah pendekatan orde pertama dari atom hidrogen menggunakan mekanika kuantum yang lebih luas dan jauh lebih akurat, dan dengan demikian dapat dianggap sebagai teori ilmiah usang. Namun, karena kesederhanaan, dan hasil yang benar untuk sistem yang dipilih (lihat di bawah untuk aplikasi), model Bohr masih umum diajarkan untuk memperkenalkan mahasiswa untuk mekanika kuantum, sebelum pindah ke yang lebih akurat tetapi lebih atom shell kompleks valensi. Sebuah model yang terkait pada awalnya diusulkan oleh Arthur Erich Haas pada tahun 1910, tetapi ditolak. Teori kuantum dari periode antara penemuan Planck tentang kuantum (1900) dan munculnya suatu mekanika kuantum full-blown (1925) sering disebut sebagai teori kuantum lama.
Pada awal abad 20, percobaan oleh Ernest Rutherford membuktikan bahwa atom terdiri dari awan difus elektron bermuatan negatif mengelilingi, kecil padat, inti bermuatan positif. Mengingat data percobaan, Rutherford alami dianggap sebagai planet-model atom, model Rutherford tahun 1911 - elektron mengorbit inti surya - Namun, kata atom planet-model mengalami kesulitan teknis. Hukum mekanika klasik (yaitu rumus Larmor), memprediksi bahwa elektron akan melepaskan radiasi elektromagnetik sementara mengorbit inti. Karena elektron akan kehilangan energi, itu akan secara bertahap ke dalam spiral, jatuh ke dalam inti. Model atom adalah bencana, karena memprediksi bahwa semua atom yang tidak stabil.
Juga, dengan elektron spiral ke dalam, emisi secara bertahap akan meningkat dalam frekuensi orbit mendapat lebih kecil dan lebih cepat. Hal ini akan menghasilkan BTA terus menerus, di frekuensi, radiasi elektromagnetik. Namun, percobaan akhir abad ke-19 dengan discharge listrik melalui gas berbagai tekanan rendah di tabung kaca dievakuasi telah menunjukkan bahwa atom hanya akan memancarkan cahaya (yaitu, radiasi elektromagnetik) pada frekuensi diskrit tertentu.
Untuk mengatasi kesulitan ini, Niels Bohr mengusulkan, pada tahun 1913, apa yang sekarang disebut model atom Bohr. Dia menyarankan bahwa elektron hanya bisa gerakan klasik tertentu:
Elektron hanya dapat berkeliling dalam orbit tertentu: pada satu set terpisah jarak tertentu dari inti dengan energi tertentu.
Elektron dari atom berputar mengelilingi inti dalam orbit. Orbit ini terkait dengan energi yang pasti dan juga disebut kulit atau tingkat energi energi. Jadi, jangan terus menerus elektron kehilangan energi ketika mereka melakukan perjalanan dalam orbit tertentu. Mereka hanya bisa mendapatkan dan kehilangan energi dengan melompat dari satu orbit diperbolehkan ke yang lain, menyerap atau memancarkan radiasi elektromagnetik dengan frekuensi ν ditentukan oleh perbedaan tingkat energi menurut hubungan Planck:

di mana h adalah konstanta Planck.
Frekuensi radiasi yang dipancarkan pada orbit periode T adalah sebagai itu akan dalam mekanika klasik; itu adalah kebalikan dari periode orbit klasik:
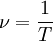
Pentingnya model Bohr adalah bahwa hukum mekanika klasik berlaku untuk gerakan elektron tentang inti hanya bila dibatasi oleh aturan kuantum. Meskipun aturan 3 tidak sepenuhnya didefinisikan dengan baik untuk orbit kecil, karena proses emisi melibatkan dua orbit dengan dua periode yang berbeda, Bohr dapat menentukan jarak antara tingkat energi dengan menggunakan aturan 3 dan datang ke aturan kuantum persis yang benar: momentum sudut L dibatasi menjadi beberapa integer dari unit tetap:
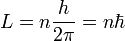
dimana n = 1, 2, 3, ... disebut sebagai bilangan kuantum utama, dan ħ = h/2π. Nilai terendah dari n adalah 1; ini memberikan orbit radius terkecil yang mungkin timbul dari 0,0529 nm yang dikenal sebagai radius Bohr. Setelah sebuah elektron dalam orbit terendah, itu bisa tidak lebih dekat dengan proton. Mulai dari aturan kuantum momentum sudut Bohr mampu menghitung energi dari orbit diperbolehkan dari atom hidrogen dan atom-lain seperti hidrogen dan ion.
Poin lain adalah:
Seperti teori Einstein tentang efek fotolistrik, rumus Bohr mengasumsikan bahwa selama lompatan kuantum dalam jumlah diskrit energi yang dipancarkan. Namun, tidak seperti Einstein, Bohr terjebak dengan teori klasik Maxwell medan elektromagnetik. Kuantisasi medan elektromagnetik dijelaskan oleh discreteness dari tingkat energi atom. Bohr tidak percaya adanya foton.
Menurut teori Maxwell ν frekuensi radiasi klasik sama dengan νrot frekuensi rotasi elektron dalam orbitnya, dengan harmonik pada kelipatan integer dari frekuensi ini. Hasil ini diperoleh dari model Bohr untuk melompat antara energi tingkat En dan En-k ketika k jauh lebih kecil daripada n. Melompat ini mereproduksi frekuensi harmonik ke-k orbit n. Untuk nilai cukup besar n (disebut Rydberg negara), dua orbit yang terlibat dalam proses emisi telah hampir frekuensi rotasi yang sama, sehingga frekuensi orbital klasik tidak ambigu. Tapi untuk n kecil (atau k besar), frekuensi radiasi tidak memiliki interpretasi klasik ambigu. Ini menandai kelahiran prinsip korespondensi, membutuhkan teori kuantum setuju dengan teori klasik hanya dalam batas jumlah kuantum besar.
Teori Bohr-Kramer-Slater (BKS teori) adalah usaha yang gagal untuk memperluas model atom Bohr yang melanggar konservasi energi dan momentum dalam lompatan kuantum, dengan hukum kekekalan hanya berpegang pada rata-rata.
kondisi Bohr, bahwa momentum sudut merupakan multiple integer dari ħ kemudian ditafsirkan kembali oleh de Broglie sebagai syarat gelombang berdiri: elektron digambarkan oleh gelombang dan seluruh nomor panjang gelombang harus sesuai sepanjang keliling orbit elektron:

Mengganti panjang gelombang de Broglie mereproduksi aturan Bohr. Bohr dibenarkan pemerintahannya dengan memanfaatkan prinsip korespondensi, tanpa memberikan interpretasi gelombang.
Pada tahun 1925 jenis baru diusulkan mekanika, mekanika kuantum di mana model Bohr elektron perjalanan di orbit terkuantisasi diperpanjang menjadi model yang lebih akurat gerak elektron. Teori baru diusulkan oleh Werner Heisenberg. Bentuk lain dari teori yang sama, mekanika kuantum modern, ditemukan oleh fisikawan Austria Erwin Schrödinger mandiri dan dengan penalaran yang berbeda.
Atom menurut Niels Bohr
Atom terdiri dari inti yang bermuatan positif disekitarnya bermuatan negatif.
Elektron beredar mengelilingi inti atom dalam keadaan stasoiner.
Enegi akan beredar tetap selama elektronberada didalam lintasan stasioner.
Elektron haya dapat berpindah dari lintasan stasioner yang lebih rendah ke lintasan stasioner yang leabih tinggi.
Elektron pada keadaan normal memiliki tingkat energi terendah.

Tidak ada komentar:
Posting Komentar